Experimentelle Hinweise
In der Chemie spielen die Elektronen, die sich in der Elektronenhülle befinden, eine zentrale Rolle. Die wichtigen Abläufe bei chemischen Reaktionen passieren in der Elektronenhülle. Es ist daher elementar zu wissen, wie genau die Elektronenhülle aufgebaut ist, resp. wo sich die Elektronen befinden.
In diesem Abschnitt soll durch die unterschiedlichen Ionisierungsenergien der Atome bewiesen werden, wie genau die Elektronenhülle aufgebaut ist.
Bei a) werden wir auf die 1. Ionisierungsenergien von einzelnen, verschiedenen Atomen eingehen.
Bei b) betrachten wir bei einem Atom die 1., 2., 3., ... respektiv n. Ionsierungsenergie.
Inhaltsverzeichnis
Ionisierungsenergie
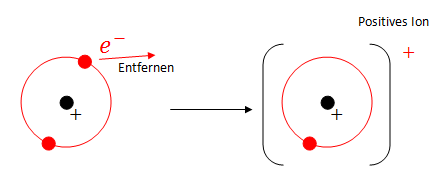
Die Ionisierungsenergie gibt an, wie viel Energie benötigt wird, um ein Elektron von einem Atom zu trennen.
a) 1. Ionisierungsenergie gemäss Ordnungszahl
(Spalte im Periodensystem)
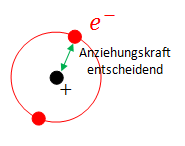
Die 1. Ionisierungsenergie hängt von der Anziehungskraft zwischen Atomkern und dem äussersten Elektron, welches man dem Atom entfernen will, ab.

Um die 1. Ionisierungsenergie gemäss Ordnungszahl zu veranschaulichen, betrachten wir die Ionisierungsenergien der ersten drei Atome im Periodensystem.
Es gibt 3 Dinge zu beachten:
a) In der Grafik sieht man, dass von Wasserstoff zu Helium die Ionisierungsenergie etwa um das doppelte zu nimmt. Das liegt daran, dass von Wasserstoff zu Helium ein Proton und ein Elektron hinzu kommen. Somit werden die Elektronen vom Kern etwa doppelt so stark angezogen und es wird etwa doppelt so viel Energie gebraucht um ein Elektron zu entfernen.
Im ersten Fall geht es also darum, dass die Elektronen viel stärker angezogen werden, wenn beim Kern ein Proton hinzukommt.
b) Von Helium zu Lithium nimmt die Ionisierungsenergie ab, obwohl wiederum ein Elektron und ein Proton hinzugekommen sind. Das heisst, es wird plötzlich weniger Energie gebraucht um das äusserste Elektron dem Atom zu entziehen.
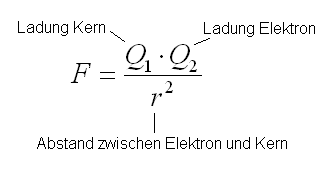
Das kann anhand des Coulomb Gesetzes nur so erklärt werden, dass das Elektron plötzlich viel weiter entfernt ist → neue Hauptschale
c) Betrachten wir uns nun in der neuen Hauptschale z.B. die Atome Beryllium und Bor. Von Beryllium zu Bor müsste die Ionisierungsenergie wieder zunehmen, da ja ein weiteres Proton/Elektron dazu kommt. Dies ist aber nicht der Fall... Was ist da passiert?
Es wäre falsch zu denken, dass es nur Hauptschalen geben würde in der Elektronenhülle, denn jede Hauptschale ist noch zusätzlich in sogenannte "Unterschalen" unterteilt. Folglich:
Diese plötzliche, leichte Abnahme ist darauf zurück zu führen, dass wir auch die Unterschalen betrachten müssen. In diesem Fall ist die 2p-Unterschale entstanden. Wenn eine neue Unterschale entsteht, zeigt sich das in einer leichten Abnahme der Ionisierungsenergie!
Vom Coulomb Gesetz wissen wir, dass die Anziehungskraft proportional zum Abstand im quadrat ist.
b) Ionisierungsenergien eines einzelnen Atoms (einer Zeile)
Ionisierungsenergien - Darstellung
Die 1., 2., 3., Ionsierungsenergie gibt an, wieviel Energie benötigt wird um das äusserste, das 2. äusserste respektiv das 3. äusserste Elektron vom Atom zu entfernen.
Allgemein steht die n-te Ionisierungsenergie dafür, wieviel Energie benötigt wird um das n-te Elektron zu entfernen.
Ein ionisiertes Atom hat eine Postive Ladung. Wie oft einem Atom ein Elektron entfernt wurde (ionisiert) wird in hochgestellten Plus angegeben. Zum Beispiel wird ein einfach ionisiertes Natrium als Na+ angegeben. Ein 3-fach ionisiertes Aluminium wird mit Al3+ gekennzeichnet. Die Ladung der Elektronen und des Kerns bleibt aber gleich, obwohl sich die Ladung des ganzen Atoms verändert hat.
Ionisierungsenergien - Veränderungen
Um die einzelnen Ionsierungsenergien zu veranschaulichen betrachten wir das Atom Natrium als Beispiel(siehe Tabelle oben).
In der Tabelle sehen wir dass die Ionisierungsenergie von Elektron zu Elektron ein wenig zu nimmt. An 2 Stellen haben wir sogar eine erheblich Zunahme der Ionisierungsenergie.
Somit müssen wir 2 Fälle unterscheiden:
• Schwache Veränderung der Ionisierungsenergie
• Starke Veränderung der Ionisierungsenergie
1. Schwache Veränderung der Ionisierungsenergie
Laut der Tabelle oben, benötigen wir immer etwas mehr Energie wenn wir ein weiteres Elektron dem Atom entfernen wollen.
(Abgesehen von den beiden Spezialfällen: 1. zu 2. Elektron und 9. zu 10. Elektron. Auf diese werden wir unten genauer eingehen.)
Diese etwas mehr benötigte Energie lässt sich auf folgendes zurückführen: Durch Entfernen eines Elektrons können die Elektronen etwas näher an den Kern rücken. Somit wird die Anziehung zwischen den nähergekommenen Elektronen und dem Kern stärker.(Aufgrund des Coulomb-Gesetzes siehe oben).
ACHTUNG: Kerne werden nicht müde! D.h. Der Kern zieht die Elektronen nicht stärker an, wenn weniger Elektronen vorhanden sind. Es spielt also keine Rolle, ob ein Atom drei oder 10 Elektronen anziehen muss. Die Anziehungskraft nimmt wegen dem näheren Abstand zu.
Schlussfolgerung: Durch Entfernen von Elektronen nimmt die Ionisierungsenergie zu, da die Elektronen immer näher zum Kern hin rücken.

2. Starke Veränderung der Ionisierungsenergie
Laut der Tabelle oben, benötigen wir vom 1. zum 2. Elektron etwa 10 mal mehr Energie um es vom Kern zu lösen. Anhand des Coulomb Gesetzes(siehe oben) schliessen wir, dass das 2. Elektron 10 mal näher beim Kern sein muss als das 1. äusserste Elektron.
In diesem Fall sieht es so aus:
• Das 1. äusserste Elektron ist in der 3. Hauptschale. • Das 2. Elektron ist in der 2. Hauptschale.
Schauen wir uns nun den zweiten starken Sprung der Ionisierungsenergie von Natrium in unserer Tabelle an:
Vom 9. zum 10 Elektron benötigen wir etwa 5 mal mehr Energie um es dem Atom zu entfernen. Dies begründen wir wiederum damit, dass das 10. Elektron in der Innersten Schale ist. In diesem Fall sieht es so aus:
• Das 9. Elektron ist in der 2. Hauptschale. • Das 10. Elektron ist in der 1. Hauptschale.
=> Neue Schale bedeutet, dass die Elektronen sich auf einmal viel näher beim Kern aufhalten, und so die Anziehung Kern - Elektron viel stärker wird.
Schlussfolgerung: Bei einer Starken Veränderung der Ionisierungsenergie befindet sich das Elektron in einer anderen Schale.
Noch 1 Hinweis:
Jedes weitere Element besitzt 1 Proton mehr! (in der Zeile)
Schlussfolgerungen
Bei a) haben wir die Gesamtheit aller Atome betrachtet und gesehen(anhand der 1. Ionisierungsenergie), dass von Helium zu Lithium das 3. Elektron plötzlich viel weiter enfernt ist. Das Elektron hat eine neue Schale angefangen. Die Elektronenhülle ist Quantisiert (Schalenförmig aufgebaut).)
Bei b) haben wir uns ein einzelnes Atom angesehen und untersucht, was beim Entfernen passiert bzw. was die Folgen sind. Entfernt man ein Elektron, nimmt die Ionisierungsenergie um weitere Elektronen zu entfernen zu (da die anderen Elektronen näher Richtung Kern rücken und somit stärker vom Kern angezogen werden).
Aus a) und b) folgt: → Die Elektronenhülle ist schalenartig aufgebaut!!
Struktur der Elektronenhülle
(Eine graphische Darstellung der Elektronenhülle die aus den Schlussfolgerungen von a) und b) folgt.)
| Schale | Nr. | Unterschalen | Ne- (max)=2n2 | |||
| s | p | d | f | |||
| K | 1 | 2 | 2 | |||
| L | 2 | 2 | 6 | 8 | ||
| M | 3 | 2 | 6 | 10 | 18 | |
| N | 4 | 2 | 6 | 10 | 14 | 32 |
| O | 5 | 2 | 6 | 10 | 14 | 50 |
| P | 6 | 2 | 6 | 10 | 14 | 72 |
| Q | 7 | 2 | 6 | 10 | 14 | 98 |
Diese Tabelle ist wie folgt zu interpretieren:
Zuerst wird immer die K-Schale gefüllt. Sie ist die Nr. 1 und besteht aus einer s-Unterschale. Eine s-Unterschale kann max. 2 Elektronen aufnehmen. Weil diese s-Unterschale zur Hauptschale Nr. 1 gehört, nennen wir sie 1s-Unterschale.
Ist die 1s-Unterschale gefüllt bzw. die K-Schale, so beginnen wir mit dem befüllen der L-Schale. Sie ist Nr. 2 und besteht aus einer s- und p-Unterschale. Diese nennen wir 2s und 2p (da sie zur Hauptschale Nr.2 gehören). Wenn wir z.B. ein Atom mit 10 Elektronen haben, so ist dies wiefolgt in der Elektronenhülle angeordnet: 2Elektroenn in der 1s, 2 Elektronen in der 2s, 6 Elektronen in der 2p.
Quellen
Ionisierungsenergie http://de.wikipedia.org/wiki/Ionisierungsenergie
Notizen aus dem Unterricht
Grafik Ionisierungsenergien http://de.academic.ru/pictures/dewiki/73/IonizationEnergyAtomicWeight.PNG