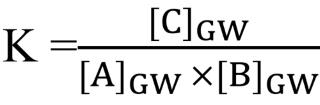Die Beeinflussung des Chemischen Gleichgewichts: Das Prinzip von Le Chatelier
Beim Prinzip von Le Châtelier handelt es sich um ein sogenanntes heuristisches Prinzip, d. h. seine Theorie basiert auf Beobachtungen oder Erfahrungen, welche zu einem richtigen Ergebnis führen, die Erklärung dahinter stellt sich jedoch als Falsch heraus. Le Châtelier geht von einer Flucht vor dem Zwang aus, was natürlich falsch ist.Es liefert jedoch keine richtig Erklärung für die Flucht, dafür sollte man zumindest einen der beiden korrekten Erklärungsansatz verstehen.
Man kann dann auch komplett auf das Prinzip von Le Châtelier verzichten und nur noch mit dem MWG und der Kinetik begründen. Das ist komplexer jedoch versteht man den Zusammenhang viel besser. Es gibt verschiedene Ansätze die Beeinflussung des Chemischen Gleichgewichts zu erklären. Beispielsweise könnte man die Beeinflussung mit dem MWG (Massenwirkungsgesetz) begründen oder mit der Kinetik begründen. Egal welche Methode man wählt beide bauen auf das Vorwissen.
So kann man auch zweigleisig Vorgegangen werden. Das Prinzip von Le Châtelier ist zwar nicht korrekt, liefert aber ein schnelles und richtiges Resultat. Das ist sehr praktisch, wenn es darum geht, die Auswirkung vorherzusagen
Die richtigen Erklärungen sind komplexer als Le Châteliers Prinzip, sind jedoch von grosser Bedeutung, wenn die Ursachen der Beeinflussung des Chemischen Gleichgewichts im Zentrum stehen
Inhaltsverzeichnis
Einleitung
Le Châtelier
Wird ein chemisches Gleichgewicht gestört, dann läuft diejenige Reaktion beschleunigt ab, die diese Störung wieder rückgängig macht. Le Châtelier argumentiert mit einem Zwang als Grund für das Ausgleichen des Gleichgewichts, deswegen auch das „Prinzip vom kleinsten Zwang“. Der „Zwang“, der dem Gleichgewicht durch die Störung auferlegt wird, wird durch die beschleunigte Reaktion kompensiert
Richtige Erklärung
Die Ursachen für die Verschiebung sind bei Konzentration, Druck und Temperatur immer ein wenig verschieden und wird in den Unterkapitel erläutert. Kurz gesagt reagieren mehr oder weniger Teilchen in eine Richtung durch die verschiedenen Beeinflussungen.
Prinzip
Ein chemisches System im Gleichgewicht versucht, äusseren Zwängen auszuweichen : Flucht vor dem Zwang
Die 3 "Zwänge"
Konzentration
Nach Le Châtelier wird beim Zwang der Erniedrigung der Konzentration einer Seite des Gleichgewichts mit der Flucht zum Erniedrigen der Konzentration der anderen Seite das Gleichgewicht wieder hergestellt.
Beispiel: A + B ⇌ C + D
Zwang: Zugabe von A - Flucht: [A] wird kleiner / Gleichgewicht geht nach rechts
Richtige Erklärung anhand der Gleichgewichtskonstante K vom Chemischen Gleichgewicht wonach sich die Hin-/Rückreaktionsgeschwindigkeit angleicht. Das Gleichgewicht verschiebt sich, bis das MWG (Massenwirkungsgesetz) wieder erfüllt ist. Hierzu ein konkretes Zahlenbeispiel:
MWG bei der Reaktion A + B ⇌ C:
Beispiel anhand von konkreten Zahlen:
[8]/[1]×[2]=4
[A]GW = 1 Mol
[B]GW = 2 Mol
[C]GW = 8 Mol
K = 4
wenn nun z. B. [A] um +1 Mol erhöht wird, so stimmt die Gleichung nicht mehr:
[8]/[1+1]×[2]=2
[A]GW = 2 Mol
[B]GW = 2 Mol
[C]GW = 8 Mol
K = 2
K ist nicht mehr 4 sondern nur 2, d. h. [C]GW muss neu gefunden werden
neues Gleichgewicht:
[16]/[1+1]×[2]=4
[A]GW = 2 Mol
[B]GW = 2 Mol
[C]GW = 16 Mol
K = 4
K wieder korrekt und [C]GW neu bei: 16
Die Formel gleicht sich der Gleichgewichtskonstante K an, da sie eine Konstante ist. Dies macht Sinn, wenn man überlegt, dass durch die erhöhte Konzentration von A es nun eine höhere Wahrscheinlichkeit gibt, dass die Teilchen einen erfolgreichen Zusammenstoss haben, wie es im Kapitel ''Die Beeinflussung der Reaktionsgeschwindigkeit'' im Unterthema Konzentration unter anderem beschrieben wird.
Anwendung Zahnschmelz
Auflösen des Zahnschmelzs:
Ca5(PO4)3(OH)(s) ⇌ 5 Ca2+(aq)+ 3 PO3-(aq)+ OH-(aq)
links: Zahnschmelz - rechts: aufgelöster Zahnschmelz
Das Prinzip von Le Châtelier besagt, dass wenn die OH- entfernt werden (Zwang), das Gleichgewicht nach rechts verschoben wird (Flucht).
Richtige Erklärung : Die Zähne werden von einem Bakterienrasen angegriffen. Diese Bakterien leben von z.B. Zucker und wandeln diesen Zucker in Säure um. Der Zucker wird also von den Bakterien in Säure umgewandelt und es entstehet eine H-Abgabe.
Zucker + Bakterien = Säure + H+
Diese H+-Ionen reagieren sehr spontan mit OH- zu Wasser.
H++ OH- → H2O
Das Wasser ist weiter nicht schlimm für unsere Zähne, aber die OH--Ionen kommen von unserem aufgelösten Zahnschmelz. Somit sinkt die OH--Konzentration auf der rechten Seite, was zur Folge hat, das vermehrt Reaktionen von links nach rechts ablaufen – das heisst, das Gleichgewicht geht nach rechts und der Zahnschmelz löst sich auf! Säure ist also für unsere Zähne schlecht. Das Gleiche passiert auch, wenn Magensäure hoch kommt (Magensäure-Reflux). Der Zahnschmelz löst sich also auf, wenn man zu viel Zucker und Säure zu sich nimmt.
Süssgetränke
Orangensaft enthält Ca2+-Ionen.
Das Prinzip von Le Châtelier besagt, dass wenn die Konzentration von Ca2+ erhöht wird (Zwang), das Gleichgewicht nach links verschoben wird.
Richtige Erklärung: Die Konzentration rechts wird erhöht. Somit wird die Rückreaktion zum Zahnschmelz schneller und das Gleichgewicht verschiebt sich nach links. Jedoch ist Orangensaft sauer! Frischer Orangensaft ist diesbezüglich noch viel schlimmer. Was weniger bekannt ist, dass Coca Cola auch extrem sauer ist. Jedoch hat es eine „Schutzfunktion“, da Coca Cola Phosphorsäure enthält:
H3PO4 + 3H2O ⇌ 3H3O+ + PO4-3 Das Prinzip von Le Châtelier besagt, dass wenn die PO4-3-Konzentration erhöht wird, das Gleichgewicht nach links verschoben wird.
Richtige Erklärung: Durch die Phosphorsäure (H3PO4) und Wasser entstehen also PO4-3-Ionen, die dem Zahnschmelzauflösen entgegenwirken. Die Konzentration rechts wird erhöht und somit ist die Rückreaktion schneller und das Gleichgewicht verschiebt sich eher nach links.
Schutz
- Bakterien-Plaque entfernen durch Zähne putzen und Zahnseide
- Zucker und Säure vermeiden
- pH-neutrale Kaugummi (z.B. V6)
- Zahnpasta mit Fluor (F-) Das Fluor ersetzt die OH--Ionen, die sehr wasserlöslich sind. Fluor ist weniger wasserlöslich und die Säuren sind weniger schädlich
Druck
Gasförmige Teilchen brauchen bei normalen Bedingungen am meisten Platz und sind deshalb alleine für den Druck verantwortlich. Flüssige und feste Stoffe können vernachlässigt werden, da man sie fast nicht zusammendrücken kann.
Wird der Druck kleiner, so muss nach Le Châtelier mit einem Druckausgleich das Gleichgewicht wieder hergestellt werden. Mit anderen Worten es werden die Aggregatzustände gewechselt. Meistens zu Gasen, da diese das grösste Volumen besitzen.
Beispiel:
A(g) + B(g) ⇌ C(g)
Zwang: Erhöhung des Drucks - Flucht: Druckerniedrigung / Gleichgewicht verschiebt sich nach rechts
Die richtige Erklärung ist abhängig von der Volumenänderung. Wird wie im Beispiel der Druck erhöht, wird das Volumen verkleinert und somit steigt die Wahrscheinlichkeit für mehr erfolgreiche Zusammenstösse. Das Gleichgewicht verschiebt sich also von den vielen gasförmigen Teilchen (links) zu denn wenigen gasförmigen Teilchen (rechts). Wenn man noch einmal einen Blick auf das Massenwirkungsgesetz wirft, so stellt man fest, dass sich K in diesem Falle verändert. Bei höherem Druck auf Gase wird auch K erhöht, d. h. es die Menge der Edukte oder Produkt, je nach dem wo mehr gasförmige Teilchen vorhanden sind, steigt bzw. sinkt.
Katastrophe
Am 21. August 1986 ereignete sich in Kamerun, genauer gesagt in der Region des Kratersees Lake Nyos eine verblüffende Katastrophe. Über Nacht starben viele Menschen und Tiere. Die Lage wurde demzufolge genau analysiert und heute hat man auch eine Erklärung, wie es zu diesem Unglück gekommen ist. Es gab in dieser Nacht einen kühlen Wind vom Norden. Dieser kühlte die obersten Wasserschichten des Lake Nyos ab.
1. Abkühlung der oberen Wasserschichten
2. Das kalte Wasser sinkt ab. (Es ist schwerer geworden durch die Abkühlung.)
3. Umwälzung der Wasserschichten, warmes Wasser geht hoch. Das Tiefenwasser ist durch die vulkanische Aktivität mit CO2 gesättigt. Unten herrscht also eine Gleichgewicht von:
CO2(g) +H2O ⇌ H2CO3(aq) (Kohlensäure)
4. Das gesättigte CO2-Wasser, welches nach oben strömt, ist immer einem kleineren Druck ausgesetzt. Le Châtelier besagt, dass wenn der Druck nach oben abnimmt (Zwang), das Gleichgewicht nach links verschoben wird, sodass der Druck wieder zunimmt (Flucht).
Die richtige Erklärung lautet: Da es auf der linken Seite mehr gasförmige Teilchen hat, spielt der Druck auf der linken Seite die entscheidende Rolle. Das vorherige Gleichgewicht wird nun nach links verschoben, da das CO2-Gas weniger „zusammengedrückt“ wird und somit weniger mit H2O reagiert.
5. Durch die Verschiebung des Gleichgewichtes nach links, entsteht immer mehr gasförmiges Kohlendioxid. Dieses steigt auf und gerät in die Luft. Und da es viel schwerer ist als die Bestandteile der Luft, ist das Kohlendioxid knapp über den Kraterrand gestiegen und dann in das Tal abgestiegen. Das war die Todesursache vieler Tiere und Menschen. Heute ist dieser Problem beim Lake Nyos gelöst, indem man das Tiefenwasser kontinuierlich hinauf pumpt und die CO2-Blasen immer aufsteigen können. Da der Druck im Innern des Rohres gering ist, bilden sich sehr einfach Blasen. Es entsteht eine natürliche, meterhohe Fontäne.
Schlittschuhlaufen
H2O(s) ⇌ H2O(l)
Eis hat ein grösseres Volumen als Wasser. Le Châtelier besagt, dass wenn der Druck von der Kufe auf das Eis erhöht wird (Zwang), das Gleichgewicht nach rechts geht (Flucht). Dadurch schmilzt das Eis kurzfristig und die Reibung wird minimiert. Die richtige Erklärung geht wieder über den zusätzlichen Schritt mit dem Volumen.
Temperatur
Eine Änderung der Temperatur muss mit einer Temperaturänderung in die entgegengesetzte Richtung ausgeglichen werden.
Beispiel:
Zwang: Temperaturerhöhung - Flucht: Temperatursenkung
Experiment Temperaturabhängigkeit
Fe3+(aq) + 2SCN-(aq) → [Fe3+(SCN)-2](aq)
| Experiment | [Fe3+(SCN)-2](aq) bei Zimmertemperatur | Erwärmen | Abkühlen |
|---|---|---|---|
| Farbe | rot | hellrot | dunkelrot |
Richtige Erklärung: Gibbs-Helmholtz-Gleichung: ΔG = ΔH - T * ΔS
Das GW ist abhängig von der Temperatur, weil sie mit der Entropie (ΔS) multipliziert wird. In diesem Fall ist ΔS ungünstig bei der Hinreaktion (also ΔS > 0), wenn jetzt der ungünstige Wert bei hoher Temperatur mit einer hohen Zahl multipliziert wird, wächst der Einfluss von ΔS auf die Reaktion und sie wird weniger freiwillig, damit ist es unwahrscheinlicher, dass die zwei Edukte zum Produkt reagieren.
| Hinreaktion →
(sichtbar beim Experiment mit den Farben) |
Rückreaktion ← | |
|---|---|---|
| ΔH | günstig (Anziehungskräfte rechts grösser) | ungünstig |
| ΔS | ungünstig (3 Teilchen zu 1 Teilchen) | günstig |
| Erwärmung | Temperaturzunahme→unspontan (ΔG=ΔH-T*ΔS)→ Rückreaktion-v>Hinreaktions-v → Komplex fällt auseinander → es wird heller, hellrot | Temperaturzunahme→spontan (ΔG=ΔH-T*ΔS)→ Rückreaktion-v<Hinreaktions-v → Komplex bildet sich |
| Abkühlung | Temperaturabnahme→ spontanter (ΔG=ΔH-T*ΔS)→ Rückreaktion-v<Hinreaktions-v → Komplex bildet sich → es wird dunkel, dunkelrot | Temperaturabnahme→unspontan (ΔG=ΔH-T*ΔS)→ Rückreaktion-v>Hinreaktions-v → Komplex fällt auseinander |
Es muss immer auf die Hin- und Rückreaktion geachtet werden. Es ist wichtig anzugeben, von was genau man spricht. Bei der Temperaturerhöhung geht das Gleichgewicht immer zur grösseren Entropie (von ungünstig zu günstig). Das Prinzip von Le Châtelier besagt, dass das Gleichgewicht immer zur ungünstigen Enthalpie verschoben wird. Ist das jetzt ein Widerspruch? Nein, denn das sind immer Dilemmareaktionen und somit ist es unwichtig, ob man von der günstigen Entropie oder der ungünstigen Enthalpie spricht. Die korrekte Begründung liegt aber bei der Entropie.
Hier findet man ein anschauliches Video: https://www.dropbox.com/s/wnbzzldf773bboi/Gleichgewicht_Eisenthiocyanat.mpg
Anwendung
Bekannt ist, dass die Glühbirne einen Draht aus Wolfram enthält. Da Wolfram einen sehr hohen Schmelzpunkt hat, ist es gut für warme Glühbirnen geeignet. Trotz hohem Schmelzpunkt gibt es einzelne Wolfram-Atome, die gasförmig werden und an das kalte Glas gelangen. So wird also der Wolfram immer dünner und irgendwann reisst er und die Glühbirne ist kaputt. Eigentlich könnte man meinen, dass man dann einfach die Temperatur senken kann und dann vielleicht die Lampe weniger hell leuchten würde. Doch das sichtbare Spektrum beim Licht ist klein (400 – 700 Nanometer). Glühbirnen sind eigentlich kleine Heizkörper, die noch ein wenig Licht abgeben (5% Licht, 95% Wärme)
Die Halogenlampen sind meist kleiner und haben eine noch höhere Temperatur. Da fragt man sich, wie das möglich ist? Warum geht der Wolfram (W) nicht noch schneller kaputt? Die Temperatur in der Mitte ist viel grösser als die Temperatur am Glas. (Tinnen>>TGlas) Den entscheidenden Vorteil der Halogenlampe ist, dass sie mit Iod gefüllt ist:
W (s) ⇌W (g)
W (g)+ 3I2 ⇌ WI6(g)
Gleichgewicht bei hohen Temperaturen: links (Entrophie gross)
Gleichgewicht bei tiefen Temperaturen: rechts
Das Ablagerungsproblem kann dadurch vermindert werden. Wolfram verbindet sich bei hohen Temperaturen mit Iod. Der Schmelzpunkt WI6(g) ist sehr hoch und es lagert sich nicht ab. Wird die Lampe nun ausgeschaltet, geht das gasförmige Wolfram, das noch vorhanden ist, in den soliden Zustand hinüber. Dadurch sinkt die gasförmige Konzentration und WI6(g) spaltet sich wieder und wird wieder am Wolfram abgelagert. Trotz allem hält der Wolfram nicht ewig. Durch z.B. Temperaturschwankungen ist die Ablagerung nicht konstant.
Die Sparlampe funktioniert nach einem ganz anderen Prinzip. Ihr Spektrum unterschiedet sich massiv von demjenigen der Glühbirne, bzw. Halogenlampe.
Zusammenfassung: Video (Simple Club)
(Link:https://www.youtube.com/watch?v=K5B5_rxli28 Simple Club Video)
Zu Beginn dieses Video wird zuerst das Prinzip von le Chatelier vorgestellt. Danach werden die drei Einflussfaktoren, welche zur beabsichtigten Änderung der Menge der Produkte oder Edukte führen, einzeln erklärt und mit Beispielen präzise aufgeführt. Der erste Einflussfaktor, von welchem die Rede ist, ist der Druck.
Merke:
- Druck: Im Video wird dies nicht deutlich erwähnt, jedoch haben wir im Unterricht gelernt, dass nur Gasteilchen für den Druck verantwortlich sind, da sie leider komprimiert werden können.
- Im Beispiel der Ammoniaksynthese im Video wird gezeigt, dass sich die Anzahl der Gasteilchen während der Reaktion ändert. Der Aggregatzustand ändert sich nicht, da die Edukte, sowie auch die Produkte gasförmig bleiben. Die Edukte weisen jedoch mehr Gasteilchen auf als schließlich das Produkt. Dies führt zu einer ungünstigen Entropie, da die Anzahl der Teilchen sinkt.
- Außerdem wissen wir, dass Gasteilchen ein großes Volumen aufweisen und dass die richtige Erklärung besagt, dass das Volumen auf der Seite mit der grösseren Anzahl Gasteilchen kleiner ist und somit der Druck grösser. In diesem Beispiel ist der Druck zwischen den Teilchen auf der Seite der Edukte grösser als auf der Seite der Produkte. Das Prinzip von Le Chatelier würde dies mit der Begründung erklären, dass der Druck auf die Seite mit den wenigen Gasteilchen flieht, erklären
- Um den Druck wieder auszugleichen, wird der Druck erhöht und das chemische Gleichgewicht verschiebt sich auf die Seite mit den wenigen Gasteilchen, um den „Stress“ zu vermeiden.
Im zweiten Abschnitt wird der zweite Einflussfaktor „Temperatur“ thematisiert. Hierbei werden die Begriffe exotherm und endotherm nochmals hervorgerufen. Danach wird mithilfe eines Beispiels der Einfluss von Temperatur auf das chemische Gleichgewicht erklärt.
Merke:
- Im Video wird erwähnt, dass eine Temperaturerhöhung für die exotherme Reaktion zum Nachteil wird. Jedoch wird nicht genau verdeutlicht wieso dies so sei.
- Uns ist aber vom Prinzip von Le Chatelier bekannt, dass das Gleichgewicht von der günstigen Enthalpie flieht und sich somit von der exothermen Reaktion fernhält, weswegen auch die obige Aussage gut nachzuvollziehen ist.
- Eine endotherme Reaktion dagegen, führt zur ungünstigen Enthapie, weswegen ihr eine Temperaturerhöhung zugunsten kommt.
- Temperaturerhöhung: Endotherme Reaktion wird gefördert und das chemische Gleichgewicht verschiebt sich nach links, um dem Stress, welcher sich auf der Seite der exothermen Reaktion befindet, zu entgehen.
- Temperaturerniedrigung: Exotherme Reaktion wird gefördert und chemisches Gleichgewicht verschiebt sich nach rechts, um dem Stress auf der Seite der endothermen Reaktion zu entgehen.
- Achtung! Im Video werden die Begriffe Entropie und Enthalpie weggelassen, welche jedoch im Zusammenhang mit dem Prinzip von Le Chatelier und der eigentlichen Erklärung nützlich wären.
- Wir wissen, dass die Enthalpie, kleiner als 0, günstig ist und zu einer exothermen Reaktion führt und eine ungünstige Enthalpie zu einer endothermen Reaktion führt. Das Prinzip von Le Chatelier besagt, dass das Gleichgewicht immer zur ungünstigen Enthalpie verschoben wird. Somit können wir ableiten, dass das Gleichgewicht auch zur endothermen Reaktion wandert. Die Auswirkung der Entropie wird auch weggelassen. Z.B, dass bei Temperaturerhöhung das Gleichgewicht zur günstigen Entropie neigt. Dies besagt auch die eigentliche, richtige Erklärung.
Im dritten Abschnitt wird noch der dritte Einflussfaktor, die Konzentration, erklärt. Außerdem wird nochmals das Massenwirkungsgesetz hervorgerufen.
Merke:
- Im Video wird mit Hilfe des Massenwirkungsgesetzes gezeigt, dass die Erhöhung der Konzentration eines Eduktes automatisch zur Erhöhung der Konzentration eines Produktes führt, da die Gleichgewichtskonstante immer konstant bleiben muss.Dies besagt auch die eigentliche Erklärung, welche wir im Unterricht besprochen haben.Die Konzentration wird auf beiden Seiten so lange angepasst, bis das Massenwirkungsgesetz wieder stimmt.
- Die Senkung der Konzentration vom Produkt bewirkt somit auch automatisch die Senkung der Konzentration der Edukte.
- Was im Video fehlt, aber noch anzufügen ist, ist, dass bei der Erhöhung der Konzentration eines Eduktes somit eine erfolgreiche Zusammenstossmöglichkeit der Teilchen erhöht wird, was wiederrum zur Erhöhung der Konzentration des Produktes führt. Somit kann man die obenstehenden Aussagen nachvollziehen und verstehen, weswegen sich die Formel de Gleichgewichtskonstante anpasst.
Quellen
- eigene Notizen aus dem Chemieunterricht 2012
- PPP von Herr Deuber
Bilder:
- Wirkung von pH-neutralen Kaugummis: http://www.rundum-zahngesund.de
- Schematische Darstellung Lake Nyos, Kamerun: http://m.uni-koblenz-landau.de
- Lichtspektrum einer Glühbirne: PPP von Roger Deuber
- Vergleich Glühbirne und Halogenlampe: http://www.gewinde-norm.de/bilder/gluehbirne.gif & http://www.planet-schule.de/warum_chemie/halogen/themenseiten/t5/images_content/schemahalogenlampe.jpg
- Lichtspektrum einer Sparlampe: http://www.narva-bel.de/de/Produkte/Energiesparlampen_1176.html