IX Seifensieden nach Kaltverfahren
Inhaltsverzeichnis
Einleitung
Bereits um 2500 v. Chr. hatten die Sumerer ein erstes seifenartiges Reinigungsmittel, deren chemisches Rezept von Ägyptern und Griechen übernommen wurde. Die beiden klassischen Arten von Seifen sind einerseits die Kernseifen, bei denen es sich um Natriumsalze von Fettsäuren handelt, andererseits die Schmierseifen, die aus Kaliumsalzen von Fettsäuren bestehen. Als Waschmittel für Textilien haben sie allerdings ihre Bedeutung verloren, da sie gegenüber modernen synthetischen Tensiden (Syndets) einige Nachteile aufweisen. Erstens reagiert Seife in Wasser zu einem gewissen Grad alkalisch. Seifen-Anionen können den Wassermolekülen ein Wasserstoffatom entziehen, wodurch Hydroxid-Ionen entstehen, die Lösung wird alkalisch. Dies kann den Stoff von Wäschestücken beschädigen.
R-COO-(aq) + H2O → R-COOH(s) + OH-(aq)
Zweitens büsst Seife in leicht säuerlichem Wasser (Anwesenheit von Oxonium-Ionen H3O+) einen Teil ihrer Waschkraft ein, da die Oxonium-Ionen je ein Wasserstoff-Atom an Seifen-Anionen abgeben, was die Seifen-Anionen in Fettsäureteilchen verwandelt; dadurch verlieren die Seifen-Anionen ihren amphiphilen Charakter und gleichzeitig ihre Waschwirkung (siehe Kapitel 4.4 Waschwirkung von Seifen).
R-COO-(aq) + H3O+(aq) → R-COOH(s) + H2O
Drittens verbinden sich Seifen-Anionen in härterem Wasser mit Ca2+-Ionen zu unlöslichen Kalkseifen. Diese werden als weissliche Kruste auf den Textilien abgelagert.
2R-COO-(aq) + Ca2+(aq) → (R-COOH)2Ca(s) + H2O
Dieselbe Reaktion läuft analog auch mit den weniger häufig auftretenden Mg2+-Ionen ab, wobei ebenfalls schwer lösliche Magnesiumseife gebildet wird.
Im Bereich der Körperreinigung und -pflege erleben traditionelle Seifen zur Zeit eine Wiederbelebung in verschiedenen alternativen Geschäften und Kräuterläden. Handgemachte traditionelle Seifen haben folgende Vorteile. Sie sind gut biologisch abbaubar und es sind viele verschiedene Sorten erhältlich. Je nach Art der Fette und Öle, die zur Verseifung verwendet werden, ändern sich die Eigenschaften der Seifen. Auch für Leute, die auf einzelne Zusatzstoffe in synthetischen Seifen allergisch sind, stellt die klassische Kernseife eine Alternative dar. Ein Nachteil kann sein, dass der ph-Wert zwischen 8 und 9 liegt und so empfindliche Haut angegriffen wird. Allzu häufiges Waschen mit alkalischen (aber auch mit synthetischen pH-Wert neutralen) Seifen sollte vermieden werden, da der natürliche Fett- und Säureschutzmantel der Haut weggewaschen wird, was zu Hautirritationen führen kann. Andererseits binden sich gerade in dieser dünnen Fettschicht diverse Staubpartikel, Bakterien und chemische Stoffe, die von Zeit zu Zeit entfernt werden müssen. Waschen ja, aber nicht zu oft. Früher genügte ein wöchentliches Vollbad. Mehr dazu findet man hier im Kapitel „Soll man Seife täglich verwenden ?“.
Abgesehen von der Wiederbelebung der klassischen Seife in Spezialgeschäften haben die ab 1930 hergestellten synthetischen Tenside (Syndets) auch in der Körperreinigung das Zepter übernommen, man denke etwa an Duschgels und Flüssigseifen.
Theorie
Verseifung
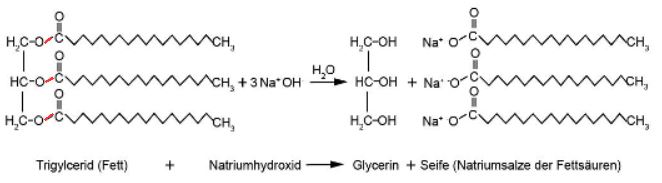
Moderne, handgemachte Seifen werden aus verschiedenen Pflanzenölen und Fetten hergestellt. Dabei kommt es auf die richtige Kombination verschiedener Öle und Fette an, um eine Seife mit den gewünschten Eigenschaften zu erhalten. Kokosöl etwa führt zu einer harten Seife mit grossporigem Schaum und einer starken Reinigungskraft, Rapsöl macht die Seife hautfreundlich und feuchtigkeitsspendend, Sonnenblumenöl ergibt eine weiche Seife, etc. Mehr dazu auf der Webseite von www.kräuterhügel.at Zur Verseifung wird meistens Natronlauge (NaOH-Lösung) verwendet. Gibt man die Natriumhydroxid-Lösung mit dem Fett zusammen, greifen drei Hydroxid-Ionen der Natronlauge die drei Esterbindungen im Fettmolekül an; in drei Schritten gelingt es den Hydroxid-Ionen das Fettmolekül in den dreiwertigen Alkohol Propan-1,2,3-triol, der üblicherweise als Glycerin bezeichnet wird, und in die konjugierte Basen der Fettsäuren zu spalten (Hydrolyse). Interessierte können sich diese Reaktion in diesem Wikipedia-Artikel im Detail anschauen. Das übrig gebliebene Na+-Ion bildet zusammen mit der konjugierten Base der Fettsäure, die eigentliche Seife.
Abb.2: Die Esterbindungen (rot) im Fettmolekül werden durch die Natronlauge geknackt. Reaktionsgleichung: C57H110O6 + 3NaOH(aq) → C3H8O3 + 3C18H35NaO2
Strukturell gesehen handelt es sich bei Seifen um Salze. Na+- oder K+-Ionen sind die Kationen, die konjugierten Basen der Fettsäuren (langkettige Carbonsäuren mit oder ohne Doppelbindungen) fungieren als Anionen. Bei der Seife in Abbildung 2 handelt es sich um Natriumstearat C18H35NaO2.
Seifensieden nach Kaltverfahren
Der Prozess der Verseifung im Kaltverfahren läuft bei Temperaturen bis maximal 80°C ab. Der Vorteil des Kaltverfahrens ist, dass das Glycerin im Reaktionsgemisch bleibt, was zu einer weichen, hautfreundlichen Seife führt. Im Gegensatz dazu wird bei den industriell im Heissverfahren hergestellten Seifen das Glycerin herausgewaschen, weil es für die Industrie zu wertvoll ist und anderweitig verwendet werden kann. Ein Nachteil gegenüber dem Heissverfahren ist, dass die Verseifung manchmal nicht zu hundert Prozent klappt und auch die lange Trocknungsphase von sechs Wochen kann ein Nachteil sein. Beim Heissverfahren kann die Seife nach ein bis zwei Tagen benutzt werden.
Fett und Lauge werden zusammen gegeben und und mit dem Stabmixer vermischt. Es bildet sich eine Emulsion, die immer dicker und puddingartiger wird. Nach der Zugabe von Duft- und Farbstoffen wird die Seife in eine Form gegossen, gut isoliert und ruhen gelassen. In den nächsten 24 bis 48 Stunden läuft die „Gelphase“ ab. Bei Temperaturen bis 80°C findet die eigentliche Verseifung statt, die Seife schmilzt und sieht glasig aus. In den darauf folgenden Tagen schneidet man die Seife in Stücke und lässt sie mindestens 6 Wochen trocknen. Eine junge Seife hat einen pH-Wert zwischen 11 und 12. Dieser sinkt aber nach einigen Tagen auf 9 bis 10. Für Leute mit einer empfindlichen Haut kann dieser recht hohe ph-Wert unangenehm sein. Als Nebenprodukt fällt wie erwähnt Glycerin an, welches aufgrund seiner hautfreundlichen und Feuchtigkeit erhaltenden Eigenschaften im Reaktionsgemisch gelassen wird.
Experimenteller Teil
Wir stellen durch eine Verseifung nach Kaltverfahren unsere eigene Seife her. Benutzt werden verschiedene Fette und Öle sowie Natronlauge und Farbpigmente.
Aufgaben
Fette
1.a. Zu welcher Gruppe organischer Verbindungen gehören Fette?
Fette sind Ester des Glycerins mit drei, meist verschiedenen Carbonsäuren, den Fettsäuren. Tierische Fette bestehen vorwiegend aus langkettigen, gesättigten (=keine Doppelbindungen) Carbonsäuren, pflanzliche vorwiegend aus kurzkettigen, ungesättigten Fettsäuren.
1.b. Wovon hängt es ab, ob ein Fett bei Zimmertemperatur fest oder flüssig ist?
Fette, deren Carbonsäuren gesättigt sind und die mehr als 10 Kohlenstoffatomen in den C-Ketten der Fettsäurereste aufweisen, sind bei Raumtemperatur fest (Schmelzpunkt höher als 20°C). Fette mit einem höheren Anteil an ungesättigten Fettsäuren und/oder kürzeren Fettsäureresten sind flüssig und werden fette Öle genannt. Je länger die Kohlenstoffketten der Fettsäurereste sind, desto höher werden die intermolekularen Van der Waals-Kräfte und desto höher wird auch der Schmelzpunkt. Dies gilt allerdings nur unter der Voraussetzung, dass sich die einzelnen Moleküle gut aneinander schmiegen können. Das ist bei Fetten mit geradlinigen, gesättigten Fettsäureresten der Fall, nicht aber bei Fetten mit verwinkelten, ungesättigten Fettsäureresten.
Fettsäuren
2. Suchen Sie in einem Chemiebuch drei verschiedene Fettsäuren heraus und zeichnen Sie deren Skelett-Formeln.
Herstellen von Seifen
3. Es wird die Verseifung am rechts abgebildeten Fett durchgeführt. Schreiben Sie die dazugehörige Reaktionsgleichung.
Bei der Verseifung mit Natriumhydroxid-Lösung entsteht Natriumstearat und Glycerin gemäss folgender Reaktionsgleichung:
C57H110O6 + 3NaOH(aq) → C3H8O3 + 3C18H35NaO2
Waschwirkung von Seifen
4.a. Warum ist ein erfolgreicher Waschprozess ohne Seife oder andere Waschmittel im Wasser nicht möglich?
Eine Reinigung von z.B. verschmutzter Kleidung mit Wasser allein ist in den seltensten Fällen ausreichend. Zum Einen durchnässt reines Wasser aufgrund seiner hohen Grenzflächenspannung Wäschestücke nur ungenügend, zum Anderen können hydrophobe Verunreinigungen wie Fette, Eiweisse oder Stärke nicht entfernt werden.
4.b. Durch Zugabe von Seifen werden die Probleme gelöst. Erklären Sie wie.
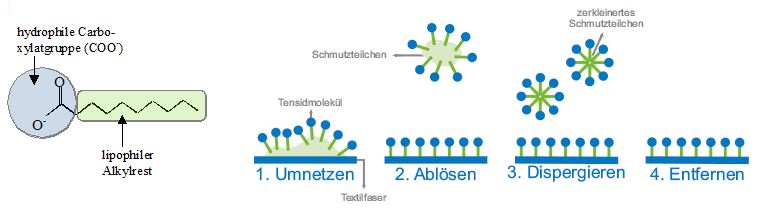
Durch Zugabe von Seife werden beide Probleme gelöst. Der lange unpolare Alkylrest des Seifenanions ist lipophil („fettliebend“), dessen Carboxylatgruppe (COO-) hydrophil („wasserliebend“); der amphiphile („beides liebende“) Charakter der Seifenanionen ist der Schlüssel zu deren Waschwirkung. Die Seifenanionen lagern sich an der Wassergrenze an, wobei ihr lipophiler Teil vom Wasser wegweist, der hydrophil Teil dem Wasser zugewandt ist. Da unter den Seifenanionen viel schwächere zwischenmolekulare Kräfte wirken als zwischen Wassermolekülen (Wasserstoffbrücken) wird die Grenzflächenspannung herabgesetzt und die Seifenlösung kann tief ins Gewebe eines Stoffs eindringen. Hydrophobe Schmutzpartikel werden von Seifenanionen umschlossen, wobei diese ihren lipophilen Teil den Schmutzpartikel zuwenden, den hydrophilen Teil zeigt zum Wasser hin. So können die Schmutzpartikel abgelöst, verkleinert (dispergiert) und entfernt werden (siehe Abb.8).
Abb.8: Wirkungsweise von Seifemolekülen (Tensidmolekülen) beim Waschprozess
Quellen
- Unterlagen: GLF Praktikum
- 09 Seife Herstellen.pdf
- Werner Eisner u.a.: Elemente. Klett und Balmer Verlag, Zug, 5. Auflage 2013.
- www.wikipedia.org
- www.seifen.at/kaltprozess.htm
- www.philognosie.net/index.php/tip/tipview/1062/
- www.kraeuterhuegel.at/s_fette.php
Bildnachweis
29.6.2015 Kay Tobler